تا به امروز، بیوتکنولوژی بیش از 200 نوع دارو و واکسن جدید تولید نموده است که محصولاتی در جهت درمان سرطان، دیابت، HIV/AIDS ، و اختلالات خود ایمنی را در بر میگیرد . بیش از 400 محصول دارویی و واکسن که حدود 200 نوع بیماری از جمله انواع مختلف سرطان ها و بیماری های آلزایمر، بیماریهای قلبی، دیابت، بیماری MS، ایدز و آرتریت را مورد هدف قرار میدهند، توسط بیوتکنولوژی تولید شده و در حال حاضر در مرحله ی آزمایشات بالینی یا Clinical trail می باشند.
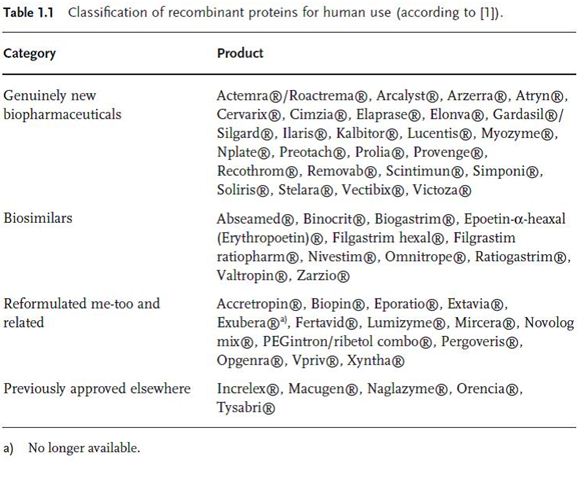
تایید میانگین 10-15 محصول در سال بیانگر این واقعیت می باشد که بیوتکنولوژی دارویی بخش بسیار فعالی است. در این میان، حدود 40% از محصولات زیست دارویی جدیدند که این خود نشاندهندهی یک مشخصه ی نوآورانه در پژوهش می باشد. برخی از این داروها مطمئنا در آینده بسیار موفق و جذاب خواهند بود.(جدول1.1). محصولات تولیدی براساس آنتی بادی مونوکلونال از جمله
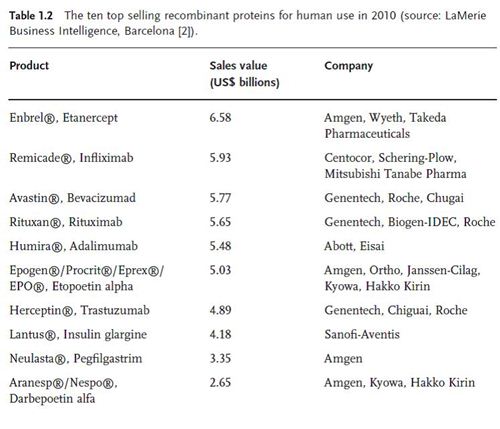
Rituximab (Rituxan ® / MabThera ® ) برای درمان سرطان با فروشی حدود 18 میلیون دلار در سال 2009 ، انسولین و آنالوگ انسولین (13.3 میلیون دلار در 2009) و همچنین محصولات با اساس اریتروپویتینی(9.5 میلیون دلار در 2009) مثال هایی از پیشرفت و تولید در این زمینه می باشند. بازار جهانی حدود 7% رشد سالیانه برای داروهای پروتئینی نوترکیب را نشان میدهد و در میان تمام دارو هایی که تا کنون خیلی موفق واقع شده اند، تنها یکی از آنها low molecular drug (مولکولهای کوچک حاصل از متابولیسم ثانویه ی باکتری ها ) می باشد، بقیه ی 4داروی پر فروش دیگر (جدول 1.2) محصولات مشتق شده از بخش بیوتکنولوژی بوده اند.(3).
شکل گیری تکنیک های جدید در بیولوژی مولکولی در جهت مهندسی پروتئین، مانند نمایش فاژی، تولید پروتئینهای متصل شده بهم، و یا طراحی سنتتیک ژن، آنقدر تکامل یافته اند که می توانند در جهت کاربرد های صنعتی در طراحی پروتئین نوترکیب مورد استفاده قرار گیرند. در گذشته در خصوص مهندسی پروتئین بیشتر به اسکلت پروتین توجه می شد، اما امروزه، رویکردهای جدید کل مولکول را مد نظر قرار می دهند. در طراحی یک موتین یا پروتین نوترکیب جهش یافته، مهندسی گلیکو و تغییرات پسا ترجمه ای و استفاده از پلیمرهای سنتزی مانند پلی اتیلن گلیکول برای حدود 80% درمانهای پروتئینی تایید شده موثر بوده است.(1)
مهندسی پروتئین
واژه ی مهندسی پروتئین بر ایجاد تغییر کنترل شده و اختصاصی در ناحیه ی ویژه ای از توالی ژن مورد نظر، که رونوشتی را به منظور تولید یک پلی پپتید کد می کند و درنتیجه آن تولید یک پروتئین جهش یافته که نتیجهی تغییرات در توالی آمینو اسیدی را از خود نشان دهد، اشاره دارد. در اصل، حذف و دخول یک یا تعدادی بیشتر از کدهای 3تایی و آمینو اسیدها امکانپذیر است. اما عمدتا تغییر توالی پروتئین محدود به تغییر اسید امینه ها در جایگاه های خاص و حساب شده می باشد. از زمان اولین آزمایشات در زمینه ی زیست شناسی مولکولی به منظور کسب درک روشن تری از بیماریها، مهندسی پروتئین بصورت موفقییت آمیزی در جهت توسعهی دارویی پروتئین های نوترکیب برای بهبود پروفایل کنتیک و دینامیک دارویی، معرفی گشته است.(4)
در سطح بیوتکنولوژیکی ، تغییرات و دستکاری های پروتئینی در خصوص برخی محصولات تجاری شده مانند انسولین، اریتروپوئتین، هورمون های رشد و انواع مختلف آنتی بادیها، بخوبی مستند شده است.
امروزه مهمترین اهداف مهندسی پروتئین عبارتند از:
بهبود پروفایل فارماکودینامیک جهت دستیابی به داروهایی که سریعتر یا کند تر عمل کنند.
تغییر نیمه عمر دارویی و توسعهی کنتیک رهش کنترل شده.
تغییر در اختصاصیت در اتصال به رسپتورها
کاهش ایمونوژنسیتی پروتئین
افزایش نیمه عمر فیزیکی و شیمیایی پروتیین
در میان 25 تولیدات زیستی جدید (NBEs ) تایید شده در اروپا و آمریکا تا 2009، تا کنون 17 پروتئین مهندسی شده تولید شده است. عمده ترین گروه آنتی بادی ها می باشند و از این میان 6 نوع آنها انسانی می باشند و یکی هم اختصاصیت دوگانه دارد(bispecific) . 17 محصول تولید شده در این میان یا به عبارتی دیگر حدود 70% از کل محصولات بیولوژیکی یا NBEsدستکاری شده اند، که 4عدد آنها آنتی بادی های انسانی شده اند.(11) همچنین در کل در میان این 25 محصول، دوتای آنها پروتئین های همجوش یا فیوز شده می باشندrilonacept- Arcalyst) و( romiplostim,Nplate.
Romiplostin که peptibody هم شناخته می شود از اتصال قطعه ی Fc از ایمنوگلوبین G1 انسانی به دومین اتصال به لیگاند از پروتئین خارج سلولی انسانی- اجزای گیرنده ی اینترلوکین 1 ( IL-1RI ) ایجاد شده برای درمان سندرم Familial cold Auto-Inflammatory ، (FCAS) یا سندرم MUCKLE-Wells ،( MWS) استفاده می گردد. جالب است که هدف از تشکیل دومین عملکردی طراحی شده از قطعات پپتیدی در مدل پروتئینی، ایجاد افزایش اختصاصیت در اتصال با رسپتور ترمبوپروتئین می باشد.
موتئین(mutein)
با توجه به کدهای ژنتیکی، بیشتر پروتئین هایی که جهت استفاده بالینی تایید شده اند، هدف، ایجاد تغییرات مستقیم در توالی یا جایجایی اسید امینه به منظور: بهبود فعالیت فارماکوسنتیک و فارماکو دیمنامیک و همچنین توسعه قابلیت آنتاگونیستی آنها بوده است. این پروتئین های مشتق شده که دارای جهش در یک جایگاه ویژه می باشند را موتئین نامیده می شوند و جزییات فارماکولوژیکی جالبی را نشان می دهند و آینده ای روشن را در پیش رو گذاشته است.
در بیوتکنولوژی کلاسیک، انسولین یکی از اولین کاندیدها برای ایجاد جهش اختصاصی و هدفمند بود. انسولین لیسبرو (انسولین لیسبرو فرمی از انسولین با عملکردی سریع می باشد که برای درمان دیابت نوع 1 استفاده می شود) در May 1996 به عنوان اولین موتین مورد تایید قرار گرفت. و تنها چند ماه بعد از آن در Nowamber 1996، بعنوان یک فاکتور فعال کننده بافتی پلاسمینوژن تایید شد. از آن زمان به بعد تعداد موتین ها بسیار افزایش یافته است و در حال حاضر هم آنتی بادی ها عمده ترین گروه آنها را تشکیل داده اند. بصورت خلاصه ما می خواهیم در این قسمت درمورد پتانسیل موتین ها برای تشکیل آنالوگهای انسولین، فعال کننده پلاسمینوژن، و آنتی بادی های انسانی بحث کنیم. انسولین طبیعی هنگامی که تزریق می شود، بعلت بالا بودن غلظت، ساختارهایی دایمری تا هگزامر تشکیل می دهند که این ساختارها موجب تاخیر در عملکرد و حل شدن در بدن می گردد. با استفاده از ساختار های مشخص انسولین، اسید امینه های پرولین و لیزین در موقعیت های 2٨ و 2٩ به ترتیب در زنجیره ی B بعنوان فاکتورهایی که در شکل گیری این ساختار ها نقش مهمی دارند شناسایی شدند و به اهدافی جهت ایجاد جهش اختصاصی تبدیل گشتند.
تعویض B28 و B29 از اسید امینه های پرولین و لیزین تمایل به شکل گیری این ساختارها را تا 300 برابر کاهش می دهند البته منجر به کوتاه شدن نیمه عمر آن هم می شود(5). در مقابل برای افزایش زمان عمل به سوی retarded drug delivery profile مفهوم مشابهی برای ایجاد جهش اختصاصی استفاده می شود.
انسولین گلارژین(Lantus ® ) یک موتینی می باشد که در زنجیره ی A آن گلیسین در جایگاه 21 بجای آسپارژین قرار گرفته است و در زنجیره ی B هم دو آرژنین به انتهایc اضافه گشته اند(6). پیامد این تغییرات از منظر شیمی فیزکی تغییر نقطه ی ایزوالکتریک، به حدود PH فیزیولوژیکی یعنی 7.4 می باشد. که این خود منجر به رسوب و کاهش انحلال آن در جریان خون می باشد.
فعال کنندهی بافتی پلاسمینوژن tPA نقش مهمی را در از بین بردن لخته های خونی ایفا می کند. همانند پروسهی تولید انسولین، جهت کسب فرم فعال آنزیمی خود باید به پلاسمین ،که فرم فعال آنزیمی دخیل در از بین بردن لخته های خونی می باشد. تبدیل گردد.
tPA با استفاده از بیوتکنولوژی، نوترکیب ساخته می شود و در بخش درمانی هم بسیار زیاد استفاده می شود. اما مشکل اصلی این است که سریعا در بدن حذف می شود. برای غلبه بر این مشکل، جهشی حذفی در ناحیه مشخصی از آن صورت گرفته و توالی اسید امینه ای از ناحیه ی 4 تا جایگاه 175 مورد حذف واقع شد. این ناحیه کد کننده دومین EGF(( epidermal growth factor بود که به هپاتوسیت ها متصل می گشت. با حذف این ناحیه، ایجاد اتصال به هپاتوسیت ها به شدت کاهش یافت. 375 اسید امینه ی باقیمانده از 527 در (Retavase ® , Rapilysin ® ) Reteplase افزایش نیمه عمری در حدود 13 تا 16 دقیقه دارد و جالب است که افزایشی 5 برابری در فعالیت نیز نشان دادند.(5،7).
سیر توسعه در طول تاریخ و همچنین فهرستی خلاصه از رویکرد های آیندهی پیشرو برای مثال سیستم رسانش یا delivery سیستم غیر تهاجمی بخوبی توسط Heller et al توصیف شده است.(8).
می توان با توجه به توانایی برقراری اتصال به سطوح بسیار اختصاصی و ساختار های کاملا یک شکل ، از زیبایی مطالعه ی آنتی بادی ها سخن به میان آورد. جدای از استفادهی آنتی بادی ها در واکسیناسیون، آنها زودتر در جهت درمان بیماری های نئوپلاستیک و جلوگیری از رد پیوند حاد برای بیمارانی که پیوند عضو شده بودند معرفی گشته بودند.
Muromonab CD3 با اسم تجاری Orthoclone OKT3 ® یک آنتی بادی مونوکلونال ایمونوساپرسور می باشد که هدف آن رسپتور CD3می باشد و استفادهی آن در جهت جلوگیری از رد حاد پیوند کلیه تایید شده است. بعد از چندین تزریق مجدد آنتی بادیهای ضد موشی می تواند تشکیل شوند که بعنوان یک اثر نامطلوب کاهش کارایی آنرا به همراه دارد. برای افزایش تلورانس، آنتی بادی کایمری از انسان و موش طراحی شد یعنی با استفاده از توالی پروتئینی ، ناحیهی ژنتیکی مورد نظر در موش تولید کننده آنتی بادی پیدا شده و با توالی کدهای ژنتیکی مربوط به ناحیهی حفاظت شدهی FCانسانی جایگزین شدند به این ترکیب کایمر گفته می شود و (جدای از حالتهای انسانی شده می باشد که در آن کل چهارچوب تعویض می گردد، می باشد) برای مثال:
و Rituximab in Mabthera ® (chimeric) ،Daclizumab, Zenapax (humanized)
Abciximab in ReoPro ® (chimeric) (9،10،11 )از نمونه آنتی بادی هایی می باشند که در لنفوم غیر هوچکین استفاده می گردند.
مهندسی پسا ترجمه ای
چندین محصول نوترکیب درمانی تایید شده وجود دارند که از طریق دستکاری های پساترجمه ای یا بعد از ترجمه تولید شده اند. در زیست شناسی مولکولی، مهندسی پسا ترجمه ای مرتبط به گلیکوزیلاسیون و لیپیداسیون پسا بیوسنتزی می باشند. بیوسنتز پسا ترجمهای پیوند کوالانسی بین گروه های شیمیایی می باشد منظور مثلا گلیکوزیلاسیون اجباری نیست بلکه اتصال اسید چرب یا تغییر در زنجیره ی PEG از یک محصول پسا ترجمه ای از پیش موجود می باشد. (به زبانی ساده تر اتصال گروههای شیمیایی دیگر در جهت ایجاد محصولی با عملکردی بهبود یافته پس از ترجمه).که بخوبی توسط Walsh مرور شده است. (9)
برای مثال Nordicks Victoza (liraglutid)یک داروی غیر انسولینی می باشد که در بهبود سطح قند خون افرادی که دارای دیابت نوع دو می باشند، بسیار مفید است و حاوی آنالوگ پپتید شبه گلوکز 1 ( GLP – 1 ) می باشد که در حدود 97% با آن همولوژی دارد و یک اسید چرب 16 کربنه به لیزین 26 آن متصل می باشد. N – ε – ( γ – Glu[ N – α – hexadecanoyl]).(10).
گلیکوزیلاسیون یکی از پیچیده ترین و گسترده ترین تغییر پسا ترجمه ای است که انجام میگیرد. امروزه مهندسی گلیکو یا Glycoengineering به یکی از عرصه های بسیار مورد توجه تبدیل شده و با تغییرات مستقیم و هدفمند الگوی گلیکوزیلاسیون در سطح اسکلت پروتئینی می توانند تغییراتی را در پروفایل فارماکو سنتیکی ایجاد کند. تقریبا 40% از پروتئین های دارویی تایید شده گلیکوزیله می باشند و سل لاین های پستانداران (مانند تخمدان همستر چینی، کلیه ی همستر بچه BKH) برای تولید آنها عمدتا استفاده می شوند. اخیرا هم تلاشهایی در جهت مهندسی گلیکو با استفاده از سیستمهای گیاهی چون( سلولهای هویچ برای تولید بتا سربروزیداز) مخمر Saccharomyces cerevisiae و Pichia pastoris در حال انجام است.
تولید آنالوگ گلیکوسربروزیداز، ایمیگلوسیراز ، برای درمان سندرم Morbus Gaucher با استفاده از سلول های CHOانجام شده است. متناوبا، پیشرفت های جدیدی که توسط کمپانی Poralix صورت گرفته نشان داده است که گلوکوسبروزیداز جهت مصرف خوراکی آن می تواند در سلول های هویچ تولید شود.
گلوکوسربروزیداز خوراکی یک فرم بیان شده در سلول گیاهی می باشد که بصورت طبیعی در سلول های گیاهی محصور شده و از نظر ژنتیکی دستکاری شده تا آنزیم را بیان کند. سلول های گیاهی ویژگی مشابهی دارند که آن هم وجود دیوارهی سلولزی در اطراف آن می باشد و آنها را در مقابل تجزیه ی آنزیمی هنگامی که از سیستم گوارشی عبور می کنند، محافظت می کند که این یک ایدهی اصلی در پشت مفهوم استفادهی خوراکی دارد.
در سیستم های گیاهی یکی از قابل توجه ترین واکنشهای ترانسفورماسیون برای خزه های دست کاری شدهی ژنتیکی توسعه یافته است.
Heilbronn یک شرکت المانی Greenovation می باشد، خزه ای را درست کرده که فاقد فعالییت گزیلوز و فوکوز ترانسفرازی می باشد.
Biolex Therapeutics, Pittsboro, NC, USA, شرکتی آمریکایی می باشد که سیستمی مشابه جهت مهندسی خزه دارد و خزه ای( Lemna minor ) تولید نموده است که فعالیت گزیلوزیل و فوکوزیل ترانسفرازی آن از طریق استفاده از RNAهای تداخلی مهار نموده است.(12).
درست بخلاف گلوکوسربروزیدازانسانی، ایمیگلوسراز، که بطور طبیعی در سل لاین CHO تولید می شود باید تحت یک مرحله پردازش آنزیمی با استفاده از اگزوکلیکوزیداز قرار بگیرد و باید از نظر بیوشیمیایی متحمل تغییراتی شود با حذف زنجیره ی اولیگوساکاریدی کلاهک گذاری شده
(sialinic acid, galactase, and N – acetyl – glucosamine) این تغییرات اعمال شود. این زنجیره تا قطعهی مانوز توسط اگزوگلیکوزیداز برش مییابد. قطعات باقیماندهی مانوز که در معرض قرارگرفته اند توسط رسپتور های مانوز بر سطح ماکروفاژها شناخته شده و برداشت آنها راحتتر صورت می گیرد. بدین طریق آنزیم بطریق موثری توسط ماکروفاژ برداشت میشود.گلیکوسربوزیداز تغییر نیافته هم اگر مصرف شود به سرعت از جریان خون توسط کبد محو می شود. تغییرات پسا ترجمه ای PEGلاسیون اسکلت پروتئینی می باشد. پلی اتیلن گلیکول PEG یکی از تکنیکهایی است که در جهت تغییر در مشخصات فیزیکی شیمیایی و بیولوژیکی پروتین مورد نظر استفاده می شود. (13) پروتئینها و پپتید های که پلی اتیلن گلیکوله شده اند، به ابزارهایی امیدوار کننده در بیوتکنولوژیی دارویی و سایر زمینه های زیست پزشکی بمنظور:
بهبود حلالیت، بهبود پایداری دمایی و مکانیکی، کاهش حساسیت زایی ایمنی، کاهش دفع کلیوی و بهینه سازی مشخصه های فارماکو سنتتیک مانند افزایش جریان خون و .. تبدیل شده اند. سراغاز این متد با تولید اینترفرون پلی اتیلن گلیکوله شده (Pegasys ® , Viraferon ® ), بود. اما امروز در حدود چهار داروی نوترکیب (Somavert ® , Neulasta ® , Oncaspar ® , Mircera ® )دیگر نیز تایید شده اند.
pegvisomant (Somavert ®) یک آنالوگ پلی اتیلن گلیکوله شده از هورمون رشد انسانی است که در باکتری اشرشیا کولای تولید می شود. 4 تا ٥ زنجیره ی PEG به اسکلت پروتئینی آن متصل شده اند تا یک پوسته هیدرودینامی را در اطراف پروتئین ایجاد کند و منجر به بهبود حلالیت و افزایش نیمه عمر آن گردد.
همچنین،Neulasta® و Oncaspar ®دو هورمون رشد دیگری هستند که از این طریق تولید شده اند. اما Micerat یک آنالوگ پلی اتیلن گلیکوزیله شده اریتروپویتین می باشد. به تبع این تولیدات پلی اتیلن گلیکوزیلاسیون به تدریج به یک اصل در زمینه ی تکنولوژی دارویی تبدیل شده است. هرچه که ترکیبات پروتئینی و پپتیدی PEGلاسیون شدهی بیشتری به فاز آخر ازمایشات بالینی می رسند، شیمی PEG لاسیون پروتئین ها توجهات بیشتری به خود جلب می کنند. با توجه به موانع موجود بر سر تولید و طراحی پروتئین های نوترکیب PEGلاسیون به رویکردی جذاب در فرمولاسیون جدید در تولیدات دارویی تبدیل شده است و PEGلاسیون های جدیدی و قابل برگشت و دستکاری نمودن PEGهای متصل شده به پروتئین های مورد نظر از مفاهیم موجود در آینده است.
بیولوژی سنتتیک
بیولوژی سنتتیک رشته ای جدید در زیست شناسی و تکنولوژی ژن می باشد. در ادامهی تحقیقات مهندسی، این رشتهی جدید در تلاش است تا علوم مهندسی، بیوتکنولوژی، ژنتیک و بیوانفورماتیک رو با هم ادغام کند.(14). فناوریهای کلیدی توانمند ریشه در بیولوژی مولکولی و ژنتیک دارند.
مفهومی که در پس بیولوژی سنتتسک موجود می باشد کاهش مراحل و اجازه ی استانداردسازی سیستمهای بیولوژیکی که biobricks نیز نامیده می شوند مانند پروموتورها و فاکتورهای رونویسی برای استفاده در سیستم های پیچیده ی زیستی می باشد.
بیولوژیست های سنتتیک متکی بر توالی یابی مقدار زیادی DNA، مهندسی پروتئین و سر انجام سرهم بندی کردن biobrick ها در جهت ساخت در میزبان تولید کنندهی مورد نظر می باشد. اگرچه تعداد ژنوم هایی که توالی یابی می گردند در حال افزایش است، اما هنوز اطلاعاتی محدود در مورد ژنهای کد کننده در گیاهان و میکروارگانیسم ها برای مثال آنهایی که دخیل در تولید محصولات ثانوی ی متابولیکی مختلف طبیعی می باشند، موجود است. با وجود اینکه بیولوژی سنتتیک هنوز در اوایل عمر خود می باشد، اما یافته هایی که تا کنون بدست امده اند بسیار تحسین برانگیز اند. در سال 2000 پژوهشگران دانشگاه وانشنگتن در آمریکا سنتز یک ژنوم 9.6 kbp از هپاتیت C را بصورت شیمیایی از 60 تا 80 مر گزارش نمودند. در 2002، پژوهشگران دانشگاه استونی بروک، در آمریکا، موفق به ساخت ژنوم Poliovirus از توالی بدست آمدهی آن به عنوان دومین ژنوم سنتزی شدند.
اولین ژنوم باکتریایی هم در 2006 توسط محققین انستیتوی Venter J. Craig مونتاژ شد.
همچنین، Mycoplasma laboratorium که مشتق شده از M. genitalium می باشد دارای یک ژنوم کوچک سنتزی است که تمام ویژگی های عملکردی را دارد و به آن اجازهی زندگی در یک سلول میزبان را می دهد. (15) بیولوژی سنتتیک از منظر تولید دارویی توجهات بیشتری را بخود جلب کرده است در سال 2004، artemisinic acid به عنوان پیش سازی برای سنتز artemisinin، دارویی ضد مالاریا، برای تولید با موفقیت به E. coli انتقال داده شد و در سال 2006 توانستند به S.CEREVISIAE نیز انتقال دهند. در سال 2007 کامفرول و کورستین مشتق شده ازگیاهان بصورت هترو در باکتری E. coli سنتز شدند. به طور میانگین سالانه 2 محصول طبیعی ثانویه می توانند به لیست مواد بیوسنتتیک ثانویه اضافه شوند. بیولوژی سنتتیک در اوایل عمر خود می باشد و هنوز بطور گسترده در لابراتوار های داروسازی در معرض قرار نگرفته است.( 16) چالشها و فرصتها از طراحی میزبان تولید کننده مناسب گرفته تا تولید پروتئین های نوترکیب کایمر و همچنین داروهای مولکولی کوچک، اداپته کردن میزبان ها در جهت بهبود فرایند طراحی در مهندسی شیمی و دارویی، و اجرا سازی طرح پزشکی شخصی بخوبی واضح می باشد. اکنون نمی توان پیش بینی کرد که، نوکلئویک اسید ها بعنوان دارو و همچنین ژن درمانی سوماتیک هم مفید واقع خواهند شد. اما بیولوژی سنتتیک ممکن است بتواند مسیرهایی در جهت طراحی سیستم های ایمن تحویل ژن و درمان را ایجاد کند.
میزبانان تولید کننده و فرایند های فرادست / فرودست
نگاهی گذرا بر ارگانیسم های تولید کنندهی بیوداروهای تولید شده نشان می دهد که از 52 محصول تولید شده در طی 5 سال اخیر 32 محصول در سلول های مشتق شده از پستانداران (تخمدان همستر چینی CHO ) 17 تا در E. coli، چهارتا در ساکارومیسز سرویزیه و 2 تای آنها در حیوانات ترانسژنیک تولید شده اند. اما امروزه میزبانهای تولید کنندهی جدید وارد صحنه شده اند
مانندPichia pastoris (Ecallanttide, Kalbitor) ، سیستم باکولو ویروسی- حشرهای (Cervarix ® ) و Daucus carota برای تولید گلوکوسربروزیداز انسانی(imiglucerase
alpha) و انتی ترومبینس (Atryn ® , Macugen ® )در گوساله استفاده می شوند.
برای افزایش اثر بخشی محصولات آن هم در این زمان که رقابت بر سر قیمت و هزینه و … می باشد باید از میزبان های تولید کننده ای استفاده شود که سطوح بیان بهبود یافته و تولید بیشتری داشته باشد.
مثلا برای پروتئین های نوترکیب تولید شده در سیستم های تولیدی پستانداران برداشت حدودا 5 g/l محصول بعنوان سطح استاندارد در نظر گرفته شده است. در آینده خیلی بیشتر از مقادیر امروزی با تولید سل لاین های با تولید بالا بدست خواهد آمد و ما قطعا تاثیر بیولوژی سنتتیک و مهندسی متابولی هوشمند را خواهیم دید. سیستم بیوتکنولوژی اجازه خواهد داد تا فرایندی معقول در جهت شناسایی و غلبه بر تنگناهای موجود در سوخت و ساز و بهینه سازی مدیا طراحی شود. از کل هزینه های مصرفی در جهت ساخت دارو حدود 80% آن مربوط به فرایند های پایین دستی می باشد و این بعلت خالص سازی یک ماده از مجموعهی متابولیکی و افزایش ایمنی زیستی در یک محیط دارویی GMP (Good Manufacturing Practice)بسیار تنظیم شده می باشد. تجهیزاتی که در این محیط مورد نیاز است برای مثال یک ستون Proess-scale در حدود 1 میلیون دلار آمریکایی می باشد، یک Depth-filter قیمتی در حدود30000 دلار می باشد یا یک سانتریفیوژ جهت جداسازی تودههای زیستی بیش از نیم میلیون دلار قیمت دارد. در سالهای اخیر بیوراکتورهای یکبار مصرف یا بیوراکتورهای تک کاره به کارخانه های داروسازی معرفی شده اند.کیسه های یکبار مصرف از اتیلن وینیل استات –پلی اتیلن کو پلیمرها تشکیل شدهاند و مورد تابش اشعه ی گاما جهت استریلیزاسیون قرار گرفته اند و در حجم های 10 تا 2000 لیتری وجود دارند.
بجز مراکز GE Healthcare, Xcellerex, Millipore,و Thermo Scientifi cتنها Satorius Stedim Biotech راه حل رضایت بخشی رو جهت یک خط تولید کامل داده است. این بیو کیسه های یکبار مصرف باید توسط نهادهایی ویژه تایید شوند و از نظر تعادل زیست محیطی منفی هم نیستند. بطور کل این کیسه های یکبار مصرف تمام نیازهای لازم در تولید GMP را فراهم نموده است اما جای تردید است که شرکت هایی که بر روی سازه های استیل سرمایه گذاری کرده اند، از این کیسه ها اسفاده کنند.
زیست شناسی سنتتسک در حال حاضر در صنعت داروسازی وارد شده و در حال بهبود بخشی فرایندهای بیوسنتزی می باشد. دو مثال ممکن است توانایی مهندسی متابولیسم و بیولوژی سنتتیک رادر نفوذ به فرایندهای زیستی آینده را به تصویر بکشد. DSM یک شرکت بیوتکنولوژی هلندی که در زمینه های تولیدات طبیعی، مکمل های غذایی و تولید آنتی بیوتیک فعالیت میکند یکی از فرایندهای موجود را جهت تولید سفالکسین بهبود داده است. با حذف حدودا 13 مرحله و جایگزینی آن با بیوترانسفورماسیون یک پروسهی جدید با صرفه جویی بالا در میزان انرژی و هزینه را ایجاد نموده است. سیتاگلیپتین، مهارکنندهی dipeptidyl-peptidas 4، یک ماده ی سنتتیک برای درمان تیپ 2 دیابت می باشد کهCodexis یک شرکت امریکایی ، یک فرایند بیوکاتالیتیک را با استفاده از ترانس آمیناز برای تولید این ترکیب با یک درجه seteroselectivity بالاتر نسبت به فرایند های سنتزی موجود توسعه داده است و در این فرایند از یک فلز بعنوان کاتالیزور نیز استفاده شده است.
Codexis جایزهی چالش شیمی سبز ریاست جمهوری از طرف سازمان حفاظت از محیط زیست امریکا را دریافت نمود و نشان داد که چگونه ترکیبات سنتتیک می توانند از مهندسی متابولیک و استراتژی های دوباره مهندسی شدن و تولید زیست کاتالیزها در تولید مواد سنتزی بهره برند.( 17)
چشم انداز آینده
توسعه و تولید پروتئین های درمانی نشان دهندهی اولین کاربرد صنعتی تکنولوژی DNA نوترکیب بود. در آغاز انقلاب بیوتکنولوژی هدف اصلی بیان و تولید کار امد پروتئین نوترکیب بود همانگونه که برای انسان وجود داشت. داستان موفقیت انسولین این فرایند را با جزئیات مستند نموده است. با توجه به درخواست ها و نیاز های فوری به انسولین شرکت های زیادی جهت تولید آن در طول دو دهه ی اخیر ساخته شده اند. امروز مقدار کافی از آن در دسترس می باشند و محصولات هم عاری از هر نوع ریسک برای آلودگی توسط پاتوژن ها یا بطور مثال پریون می باشند. پیشرفت ها در علوم پروتئین، ژنتیک و زیست شناسی مولکولی فرصت های جدیدی را برای تولید پروتئین های نوترکیب جهت رویارویی با مدیریت بهتر بیمار و اختصاصیت فعالیت دارویی فراهم نموده است. نوآوری در صنعت داروسازی وابسته به تولید و طراحی داروهای جدید و ایمن با در نظر گرفتن عملکرد و مقرون به صرفه بودن آنها از نظر هزینه (با این ویژگی ها حتی اگر با قیمت بالاتری نسبت به تولیدات مشابه هم بفروش برسد.) وابسته است. ظهور بیولوژی سنتزی و همچنین ادغام آن با بیوتکنولوژی و علوم ژنتیکی در فرایند های توسعه ی دارویی به شرکت های داروسازی این امکان را می دهد که برای هر دارو حدود 300 میلیون دلار در حدود یک سوم هزینه های امروزه صرفه جویی کنند و این چشم انداز را دارد که داروها یک یا دو سال زودتر به بازار وارد شوند. هر روز تاخیر در عرصه ی داروها به بازار در حدود 1.٥ میلیون دلار در روز ضرر می رساند و نشان دهنده ارزش موثر و بهینه ی تحقیقات و همچنین انتخاب استراتژی های مناسب در این عرصه می باشد. بیولوژی سنتتیک بیانگر فعالیت ادغام شدهی بین مهندسی زیستی، بیوفیزیک و علوم کامپیوتر می باشد اما امروزه مشارکت متخصصین بالینی در جهت انتقال موفقیت آمیز این تکنولوژی ها در عرصه های بالینی و درمانی بسیار ضروری می باشد. همچنین میکروارگانیسم ها به عنوان ابزاری در جهت آزمایش های بیولوژی زیستی می باشند اما پیشرفت و حرکت به سمت استفاده در سلول های پستانداران برای اثبات توسعه ی ساختار های تحقیقاتی برای درمان بیماران ضروری می باشد.(18).
References
1 Walsh , G. ( 2010 ) Biopharmaceutical benchmarks 2010 . Nat. Biotech. , 28 , 917 .
2 La Merie Business Intelligence ( 2010 ) R & D Pipeline News. Special edition,
March 2010. http://www.pipelinereview.com (accessed 10 November 2011).
3 Goodman , M. ( 2009 ) Sales of biologicals to show robust growth to 2013 . Nat. Rev.
Drug Discov. , 8 , 837 .
4 Singh , R. ( 2011 ) Facts, growth and opportunities in industrial biotechnology .Org. Process Res. Develop. , 15 , 175 .
5 Pancholia , A.K. , Sambi , R.S. , and Krishna , C.K. ( 2009 ) Current problems with thrombolytic agents in the management of acute myocardial infarction . Indian Heart J. , 61 ( 5 ),476 – 479 .
6 Berti , L. , et al . ( 1998 ) The long acting human insulin analog HOE901: characteristics of insulin signaling in comparison to Asp(B10) and regular insulin . Hormon. Metab. Res. ,30 , 123 .
7 Simpson , D. , Siddiqui , M.A. , Scott , L.J. , and Hilleman , D.E. ( 2006 ) Reteplase: a
review of its use in the management of thrombotic occlusive disorders . Am. J.
Cardiovasc. Drugs , 6 , 265 .
8 Heller , S. , Kozlovski , P. , and Kurtzhals ,P. ( 2007 ) Insulin ’ s 85th anniversary – an
enduring medical miracle . Diabetes Res.Clin. Practice , 78 , 149 .
9 Walsh , G. ( 2010 ) Post – translational modifi cations of protein biopharmaceuticals . Drug Dis. Today ,15 , 773 .
10 Rebel , U. , et al . ( 2004 ) NN2211: a long – acting glucagon – like peptide – derivative with anti – diabetic effects in glucose – intolerant pigs . Eur. J.Pharmacol. , 451 , 217 . Weblinks 13
11 Shaaltiel , Y. , Bartfeld , D. , Hashmueli , S. ,Baum , G. , Brill – Almon , E. , Galili , G. ,
Dym , O. , Boldin – Adamsky , S.A. , Silman ,I. , Sussman , J.L. , Futerman , A.H. , and
Aviezer , D. ( 2007 ) Production ofglucocerebrosidase with terminal mannose glycans for enzyme replacement therapy of Gaucher ’ s disease using a plant cell system . Plant
Biotechnol. J. , 5 , 579 .
12 Decker , E.L. and Reski , R. ( 2007 ) Moss bioreactors producing improved
biopharmaceuticals . Curr. Opin. Biotechnol. , 18 , 393 .
13 Jevsevar , S. , Kunstelj , M. , and Porekar ,V.G. ( 2010 ) PEGylation of therapeutic
proteins . Biotechnol. J. , 5 , 113 .
14 Tyo , K.E. , Alper , H.S. , and Stephanopoulos , G.N. ( 2007 ) Expanding
the metabolic engineering toolbox: more options to engineer cells . Trends
Biotechnol. , 25 , 132 .
15 Gibson , D.G. , et al. ( 2008 ) Complete chemical synthesis, assembly, and
cloning of a Mycoplasma genitalium genome . S cience , 319 , 1215 .
16 Aldrich , S.C. , Newcomb , J. , and Carlson ,R. ( 2007 ) Genome Synthesis and Design Futures: Implications for the U.S. Economy (Bio – Economic Research
Associates [bio – era], LLC, Stockbridge,VT, 2007). http://www.bio – era.net/
reports/genome.html (accessed 17January 2012).
17 Lutz , S. ( 2010 ) Biochemistry. Reengineering enzymes . Science , 329 , 285 – 287 .
18 Ruder , W.C. , Lu , T. , and Collins , J.J.( 2011 ) Synthetic biology moving into
clinics . Science , 333 , 1248 .
Weblinks
Biotechnology Industry Organization:Washington, DC Everyday products, synthetic biology report, Current Uses of Synthetic Biology for Chemicals and Pharmaceuticals http://bio.org/ind/syntheticbiology/Synthetic_Biology_Everyday_Products.pdf (accessed 17January 2012)
Landau , R. and Arora , A. (October 1999 ) The chemical industry: from the 1850s until today. Retrieved from Business Services Industry: http://findarticles.com/p/
articles/mi_m1094/is_4_34/ai_56973853/?tag=content;col1 (accessed 17 January 2012)
US Presidential Green Chemistry Challenge Award for Sitagliptin synthesis. http://www.pharmamanufacturing.com/industrynews/2010/130.html (accessed 17 January 2012)
Atryn, the fi rst approved antothrombin from transgenic goats. http://news.bbc.co.uk/2/hi/science/nature/4746736.stm (accessed 17 January 2

ضمن تشكر از مطالب عالي تون
بخش فرايندهاي فرو دست و فرادست پاراگراف اول كمي مشكل ساختاري و عددي دارد