تاریخچه
سل از قدیمی ترین امراض شناخته شده بشری بوده است. قدمت بیماری سل تقریبا به اندازه قدمت بشریت می باشد. بیماری سل می تواند به شکل های متفاوتی ظاهر شود و حتی استخوان ها را مورد حمله قرار داده و باعث تغییر شکل در استخوان ها گردد. بافت های سخت مانند استخوان ها می توانند باکتری را برای هزاران سال در خود حفظ کنند، به طوری که باکتری عامل بیماری سل را می توان در اجساد انسان هایی که در بیش از ۴۰۰۰ سال پیش در اثر سل استخوانی مرده اند، یافت. فراوانی اسکلت های کشف شده با ظاهر استخوان های تغییر شکل یافته سلی در مصر قدیم نشان می دهد که این بیماری درجمعیت آن زمان مصر شایع بوده است. همچمنین کشف استخوان های تغییرشکل یافته مشابه، متعلق به دوران نوسنگی در مناطق مختلف در کشورهای ایتالیا، دانمارک و نیز کشورهایی در خاورمیانه نشان می دهد که توبرکلوزیس از هزاران سال پیش در سر تا سر دنیا وجود داشته است
در تمدن قدیم چین، سل را به بیماری اطلاق می کردند که به ریه سرایت می کرد و علایم مشخص آن لاغری، سرفه و خلط خونی و چرکی بوده است. بقراط شايد اولين دانشمندي است كه بيماری سل را به تفصيل توضيح داده و از انديشمندان بزرگ ايراني از جمله رازی نيز آن راشرح داده است.
ميكروب و محلول تست توبركولين توسط رابرت كخ آلماني (1910-1923) كشف و تحولي اساسي در شناخت بيماري ايجاد كرد همچنين كالمت و گرين در سال 1921 با كشف مكرر ميكروب سل گاوي واكسن BCG را توليد كردند. درجريان انقلاب صنعتي در قرن 18 و 19 بيماري سل را طاعون سفيد مي ناميدند.
کخ در مقاله تاریخی خود تحت عنوان سبب شناسی بیماری سل شکل میکروب را چنین توصیف می کند: آنها میله ای شکل بوده و به گروه باسیل ها تعلق دارند، بسیار باریک و از نظر شکل و اندازه تشابه کامل به باسیل جذام دارند و فرق آنها در این است که کمی بلندتر و دارای انتهای قلمی می باشند.
در سال ۱۸۹۰، کخ کشف توبرکولین را اعلام نمود. وی تصور می کرد می تواند از توبرکولین به عنوان داروی ضد سل استفاده کند امروزه استفاده از توبرکولین در تشخیص و اپیدمیولوژی سل اهمیت زیادی دارد. در سال ۱۹۲۱ کالمت و گرین موفق به کشف واکسن BCG در سال ۱۹۲۱ کالمت و گرين موفق به کشف واکسن BCG شدند. سويه اصلي واکسن BCG يک سويه گاوي از نوع نوکارد بود. کالمت و گرين اين سويه را روي محيط سيب زميني که صفراي گاوي به آن افزوده شده بود کشت دادند.
پس از هر بار کشت خصوصيات ايمنی دهنده آن را بررسي کردند. به مرور زمان واکسن BCG جديد منتقل گرديد، تا سرانجام سويه يافت شده مورد استفاده کشورهاي مختلف قرار گرفت، تا اينکه در سال ۱۹۵۰ استفاده آن در تمام دنيا متداول گرديد
تصور مي شود كه احتمالأ بيماري سل از طريق مهاجرت چوپانان گله هاي گاوهاي هندو اروپايي كه با گاوهاي آلوده به اين باسيل در تماس بوده اند، به ديگر مناطق حمل و انتقال داده شده است. تجزيه و تحليل صفات فنوتيپي مثل تحمل لاكتوز كه با پرورش گاوهاي شيرده همراه بوده، آشكارا باعث ظهور مايكوباكتريوم توبركلوزيس شده است، پيشنهاد مي كند كه اقوام هندو -اروپايي بيماري را در خلال مهاجرتشان به اروپا و آسيا، به اين مناطق نيز گسترش داده اند. انفجار جمعيت در اروپا در هزاره دوم ميلادي و رشد مراكز بزرگ شهري، كانون و مركز شروع بسياري از اپيدمي هاي بيماري سل در قرون شانزدهم و هفدهم بوده است
اين بيماري در نيمه دوم قرن نوزدهم در اروپا به اوج خود رسيده و تخمين زده ميشود كه حدود 4/1ميليون نفر از جمعيت مردم اروپا از اين بيماري مرده اند. در اواخر قرن نوزدهم مرگ و مير ناشي از سل كاهش يافت و اين موضوع بطور وسيعي ناشي از رعايت اصول بهداشتي و خانه سازي بوده است.كاهش ميزان ناتواني و مرگ و مير ناشي از سل در خلال قرن بيستم در كشورهاي پيشرفته ،به دليل آموزش بهداشت عمومي بهتر،استفاده گسترده از واكسن BCG تهيه شده از سويه ضعيف شده مايكوباكتريوم بوويس و همچنين گسترش و توسعه آنتي بيوتيك ها در دهه 1950 بوده است. اين روند كاهش، در اواسط دهه1980 پايان يافت و بروز موارد جديدي از بيماري رو به افزايش گذاشت. از علل عمده اين حالت، روند افزايش بي خانماني و فقر در دنياي در حال توسعه و ظهور بيماري ايدز بود كه باعث ناتواني و يا انهدام پاسخ ايمني وابسته به سلول در افراد مي شد
در سال ۱۹۴۴ واکسمن و همکارانش استرپتومایسین را که اولین آنتی بیوتیک موثر و دارای اثر باکتریسیدال بر علیه مایکوباکتریوم توبرکلوزیس بود را کشف نمودند.
فاصله زمانی 1970 تا اواخر دهه ی 1980،که در این ایام ریفامپسین معرفی گردید و تهیه درمان شیمیایی کوتاه مدت برای سل و جذام ممکن شد. پس از یک دهه تحقیقات وسیع کلینیکی که توسط پروفسور میتچسون و پروفسور فاکس مشاورین تحقیقات پزشکی بریتانیا و همکارانشان در خارج انجام گرفت ،نشان داده شد که رژیم 6 ماهه ی دارویی خوراکی، اکثریت مبتلایان به سل را بهبود می بخشد. این رژیم با روش درمانی 3000 دز در یک دوره دو ساله که در اوایل کشف درمان شیمیایی به کار می رفت کاملا مغایر بود. با افزایش سریع و ویرانگر تاثیر عالمگیری HIV بر سل و پیدایش مقاومت های چند دارویی، اینک به ابداع معیارهای کنترلی مانند ایمنی درمانی از نوع تثبیت شده و نیز بیش از هر چیز دیگر به دیدی روشن برای درک افزایش سریع و روزانه اوژانس جهانی سل نیازمندیم
مایکوباکتریوم
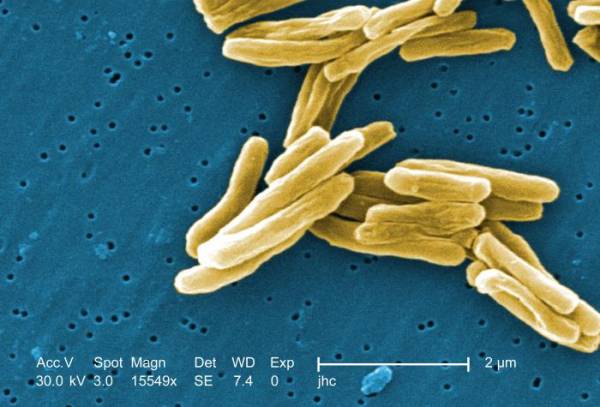
مایکوباکتریوم توبرکلوزیس، ارگانیسمی میلهای شکل، بلند و خمیده و دارای انتها برجسته بدون تولید اسپور و فاقد کپسول است، کاتالاز و اکسیداز مثبت اند. براساس شرايط رشد و سن کشت، اندازه و شکل باسيل کمي ممکن است تغيير کند .عرض باکتري ۶/۰-۲/۰ و طول آن ۱ تا ۱۰ ميکرومتر است .(ROM, 1996) ایجاد شکل تسبیح مانند در زیر میکروسکوپ بدلیل وجود گرانول ها و واکوئل های حاوی فسفات می باشد. این باکتری هوازی اجباری است و بدون اکسیژن رشد نمی کند
ویژگی های متعددی در مایکوباکتریوم ها وجود دارد که مایکوباکتریوم توبرکلوزیس و مایکوباکتریوم های دیگر را از بیشتر با کتری های گرم مثبت و گرم منفی متمایز می سازد. بیشتر این اختلافات به واسطه ماهیت دیواره سلولی مایکوباکتریوم ها می باشد. مایکوباکتریوم ها یک لایه پپتیدوگلیکان دارند اما معرف های رنگ گرم قادر به نفوذ در آن نیستند. دلیل آن وجود لایه های چربی است که اطراف پپتیدوگلیکان مایکوباکتریومی را احاطه کرده است. اکثر این لیپیدها مایکولیک اسید نامیده می شوند. محتویات چربی ها ممکن است به 60% وزن سلولی (20-5% چربی دربیشتر باکتری های گرم منفی) برسد. مایکوباکتریوم ها به مرحله رنگ زدایی توسط اسید- الکل مقاومت داشته و از این رو به باسیل های اسید- فست موسوم می باشند. روش های رنگ آمیزی اسید فاست (مقاوم به اسید) از قبیل: روش زیل- نلسون به صورت یک نیروی محرک و قدرتمند توسط حرارت سلول را رنگی می نماید. بعضی از مایکولیک اسیدها، فاکتور طنابی نامیده می شوند چون مسئول ایجاد رشته های مارپیچ هستند که مایکوباکتریوم ها وقتی که بر روی محیط های کشت معین کشت می شوند تولید می کنند. سلول های مایکوباکتریایی هر 24-18 ساعت تقسیم می شوند. این طولانی بودن زمان تکثیر منعکس کننده مدت زمانی است که جهت ظهور کلنی ها و توسعه و رشد باکتری بر روی محیط های آزمایشگاهی معین (از 10-2 هفته بسته به نوع گونه) مورد نیاز می باشد. از طرف دیگر بیانگر مدت زمان لازم برای بروز علائم بیماری (چندین هفته تا چندین ماه) می باشد. مایکوباکتریوم ها پیگمان هایی تولید می کنند که این پیگمان ها تحت هر شرایط محیطی تولید شده و اسکوتوکروموژن نامیده می شوند. بعضی مایکوباکتریوم ها پیگمان هایی تولید می کنند که این پیگمان ها فقط در حضور نور تولید شده و فوتوکروموژن نامیده می شود
رده بندي سيستماتيک
مايکوباکتريومها از تيره مايکوباکترياسه و از خانواده اکتينومايستها نامگذاري ميشوند که داراي درصد G+C بالايي در ساختارDNA خود هستند. مايکوباکتريوم و ديگر جنسهاي وابسته، مانند کورينه باکتريوم، نوکارديا، رودوکوکوس ساختار و اجزاي ديواره سلولي مشابه دارند و از اينرو داراي برخي شباهتهاي فتوتيپيکي مي باشند. برخي اسيدهاي مايکوليک در ساختار غشاء باعث تمايز مايکوباکتريها مي شود
اساس تقسيم بندي ميكوباكتريوم ها بيشتر بر خصوصيات ريخت شناسي)مرفولوژيك(، ايجادپيگمان، سرعت رشد و … استوار مي باشد
در واقع رانيون در طبقه بندي ميكوباكتريوم ها ، سرعت رشد و ايجاد پيگمان را به عنوان اساس طبقه بندي درنظر گرفته است گودفلو در سال1980، ُمعيار اصلي را سرعت رشد درنظر گرفت
جنس مایکوباکتریوم به دو گروه تقسیم میشوند :
1)میکوباکتریومهای کمپلکس توبرکلوزیس: این مایکوباکتریومها به نام مایکوباکتریوم های سلی نیز شناخته می شوند. در این گروه ، میکوباکتریوم توبرکلوزیس، میکوباکتریوم آفریکانوم و میکوباکتریوم اولسرانس قرار دارند.
2)میکوباکتریوم های آتیپیک: میکوباکتریوم های غیر معمولی یا میکوباکتریوم های غیر سلی ، گاهی به ندرت در موارد نقص سیستم دفاعی موجب بروز بیماری در انسان می گردد. این گروه به نوبه خود بر اساس سرعت رشد و توانایی تولید رنگدانه تقسیم می شوند:
الف- میکوباکتریومهای سریع ارشد : که مدت 7 روز رشد می کنند.
ب- فوتوکروموژن ها :که در مجاورت نور ،رنگدانه تولید می کنند.
ج- اسکوتوکروموژن ها : که در مجاورت تاریکی ،رنگدانه تولید می کنند.
د- نان کروموژن : که نه در مجاورت نور و نه در مجاورت تاریکی، رنگدانه تولید نمی کنند (م،رحیمی،1388).
بيماري زايي
سير بيماري سل در بسياري از موارد از يک الگوي عمومي که توسط والگرن (wallgren) شرح داده شده است پيروي ميکند. وي جزئيات پيشرفت بيماري و نتيجه بيماري سل را به چهار مرحله تقسيم کرده است (Nasr Esfahani, 2010).
مرحله اول: از 3 تا 8 هفته پس از ورود مایکوباکتریوم توبرکلوزیس توسط آئروسل های استنشاق شده به حبابچه های ریوی شروع می شود، باکتریها توسط جریان لنفاوی به غدد لنفاوی ناحیه ای در ریه ها انتشار پیدا می کنند و فرمی که کمپلکس اولیه یا گان (Ghon) نامیده می شود تشکیل می گردد. در این زمان است که پاسخ به توبرکولین رخ می دهد
مرحله دوم: حدود 3 ماه به طول می انجامد که توسط ورود باکتری های عامل بیماری از طریق جریان خون به قسمت های دیگر ریه ها و نیز اندام های دیگر مشخص می شود، در برخی افراد در این زمان بیماری می تواند به شکل مننژیت توبرکولی یا سل ارزنی حاد و کشنده (سل منتشر شونده) اتفاق افتد
مرحله سوم: در طی این مرحله تورم پرده جنب یا التهاب سطوح ریوی می تواند رخ دهد که 3 تا 7 ماه پایدار می ماند و سبب ایجاد درد شدید قفسه سینه می شود، با این حال، وقوع این مرحله می تواند تا 2 سال به تاخیر افتد. اینطور تصور می شود که بوجود آمدن این حالت بخاطر انتشار خونی و رها شدن باکتری ها، درون فضای پلور و تجمع باکتریایی در قسمت تحتانی، در فضای ریه می باشد. در این حالت احتمالا، باکتری های آزاد یا فراورده های آنها با جزء CD4 لنفوسیت های T حساس شده، واکنش نشان داده که این عمل سبب جذب باکتریها و سپس ازدیاد و تکثیر آنها و آزاد ساختن سیتوتوکسین های التهابی می شود
مرحله چهارم: در آخرین مرحله یا مرحله رفع کمپلکس ابتدایی بیماری فاقد پیشرفت می باشد و ممکن است تا 3 سال ادامه یابد. در این مرحله، توسعه بیماری بسیار آهسته و کند بوده و آسیب های ایجاد شده خارج ریوی مثل آسیب های استخوانی یا ترکیبی از آسیب ها (آسیب های استخوانی و غدد لنفاوی) در برخی افراد مشاهده می شود، هر چند بیشتر افرادی که به باکتری عامل بیماری سل آلوده می شوند پیشرفت بیماری را نشان نمی دهند
انواع محیط های کشت
محيط لازم براي کشت اوليه مايکوباکتريها بايد شامل يک محيط غير انتخابي و يک محيط انتخابي باشد. محيط انتخابي بايد حاوي آنتي بيوتيکهايي براي جلوگيري از رشد بيش از حد ساير باکتريها و قارچ هاي آلوده کننده باشد. سه فرمول عمومي وجود دارد که مي تواند هم براي محيط هاي کشت انتخابي و هم براي محيط هاي کشت غير انتخابي مورد استفاده قرار بگيرد، شامل:
محيط آگار نيمه مصنوعي: اين محيط ها (مانند ميدل بروک 7H10 و 7H11) حاوي انواع خاصي از نمک ها، ويتامين ها، کوفاکتورها، اسيد اولئيک، آلبومين، کاتالاز، گليسرول، گلوکز و سبز مالاشيت مي باشند. اين محيط ها به عنوان محيط هاي انتخابي به کار مي روند.
محيط تخم مرغ سفت شده(lewenstein-jensein): اين محيط ها (مانند لوين اشتاين جانسون) حاوي انواع خاصي از نمک ها، گليسرول، مجموعه اي از مواد آلي (مانند تخم مرغ تازه يا زرده تخم مرغ و ساير ترکيبات مختلف) مي باشند. اين محيط ها با افزودن آنتي بيوتيکهايي به عنوان محيطهاي انتخابي به کار مي روند.
محيط آبگوشت گلیسیرین دار: (مانند ميدل بروک 7H12 و 7H9) تکثير نمونه هاي کوچک را ميسر مي کنند.
سایر محیط های کشت آلی مایکوباکتریوم توبرکلوزیس شامل محیط دورسه (Dorset)٬ محیط پترف(Petroff), محیط پتراگنانی(Petragnani) و محیط هرالد (Herrold) می باشند.
درمان سل :
داروهای ضد سل را بر اساس درجه اهمیت آنها به دو دسته داروهای رده اول و دوم تقسیم بندی می کنند.
پنج داروی ضد سل رده اول عبارتند از: ایزونیازید (INH)، ریفامپین (RIF)، پیرازین آمید (PZA)، اتامبوتول (EMB) و استرپتومایسین (SM). که این داروها، داروهای اصلی در درمان سل محسوب می شوند
در مواقعی، رژیم های درمانی رایج و متداول (داروهای ضد سل رده اول) برای درمان بیمارانی که با سویه های مقاوم به دارو به ویژه مقاوم به چند دارو (MDR-TB) آلوده شده اند پاسخگو نیست. لذا برای درمان چنین بیمارانی، سازمان بهداشت جهانی و IUATLD[1] (اتحادیه بین المللی مبارزه با سل و بیماریهای ریوی) داروهایی را تحت عنوان داروهای جایگزین (رده دوم) معرفی نموده است. برخی از این داروها عبارتند از: افلوکساسین، سیبروفلوکساسین، آمیکاسین و کانامایسین .
استفاده از هر کدام از این داروها به تنهایی، منجر به انتخاب طبیعی سویه های مقاوم به داروی عامل بیماری می گردد که در جمعیت باکتریائی وجود دارد و این موضوع نشان می دهد که چرا بایستی در درمان بیماران مبتلا به سل چندین دارو بطور همزمان تجویز گردد
درمان یا به اصلاح شیمی درمانی سل از دهه 1940 و پس از کشف استرپتومایسین آغاز شد تقریبا بلافاصله پس از این مشخص شد که مونوتراپی با (streptomycin ) SM منجر به شکست درمان به علت بروز میکروب های مقاوم به این دارو شده است سپس PAS (آمینوسالیسیلک اسید) و ایزونیازید به همراه استرپتومایسین به کار گرفته شدند با استفاده از این رژیم درمانی بویژه همراه با بستری کردن بیمار در بیمارستان ها و آسایشگاه ها و لزوما استفاده از روش درمانی مستقیم پدیده مقاومت برای چندین سال بسیار نادر شد.
موفقیت درمان وابسته به دو عامل، حساسیت ارگانیسمها به دارو و خطر ابتلا به عوارض سمی شدید ایجاد شده توسط این عوامل میباشد. بر خلاف اکثر عفونتهای تحت درمان با آنتیبیوتیک، دورهی درمان بیماری سل، ماهها و یا حتی سالها ممکن است طول بکشد. درمان دراز مدت، یکی از چالشهای مهم در کنترل بیماری است ( Chopra et al., 1998) و همچنین، تنها راه مؤثر پيشگيري از انتشار بيماري و نيز جلوگيري از بروز مقاومتهاي داروئي، اجراي درمان تحت نظارت مستقيم بر مصرف دارو توسط بيماران (DOTS[2]) ميباشد
راهبرد DOTS
اساسی ترین و مهم ترین راه جلوگیری از پیدایش سویه های مقاوم و فوق مقاوم در جامعه اجرای کامل و اصولی استراتژی[3]DOTS )راهبرد درمان کوتاه مدت تحت نظارت مستقیم( می باشد
در راهبردDOTS بیماران جدید با رژیم کوتاه مدت شش ماهه و بیماران تحت درمان مجدد با رژیم کوتاه مدت هشت ماهه درمان می شوند که هر دوي این رژیم هاي درمانی مشتمل بر دومرحله هستند:
مرحله اول ( مرحله حمله اي )؛ که در “گروه اول درمانی ” به مدت دو ماه با 4دارو (ایزونیازید، ریفامپین، پیرازینامید و اتامبوتول) و در “گروه دوم درمانی” ابتدا به مدت 2 ماه با 5 دارو (ایزونیازید، ریفامپین، پیرازینامید ، اتامبوتول واسترپتومایسین) و سپس به مدت یکماه با 4 دارو (ایزونیازید، ر یفامپین، پیرازینامیدو اتامبوتول) درمان به صورت روزانه انجام می گیرد . دراین مرحله اکثر باسیل ها کشته می شوند
مرحله دوم ( مرحله نگهدارنده)؛ که در “گروه اول درمانی ” به مدت چهار ماه با 2 داروي (ایزونیازید و ریفامپین) و در “گروه دوم درمانی” به مدت 5 ماه با 3داروي (ایزونیازید، ر یفامپین و اتامبوتول) به طور روزانه ادامه می یابد . دراین مرحله باکتري هاي باقیمانده و باکتري هاي فاز نهفته نابود خواهند شد
اجرای صحیح این روش بهترین راه پیشگیری از بروز موارد مزمن سل و جلوگیری از گسترش سویه های MDR و XDR در جامعه است. به عبارت دیگر، بهترین راه پیشگیری از ایجاد مقاومت دارویی، پیروی از دستورالعمل کشوری مبارزه با سل یعنی تجویز صحیح، مناسب و کامل رژیم درمانی تحت نظارت مستقیم یک ناظر دلسوز، علاقمند و آموزش دیده برای موارد سل حساس به دارو است
موفقیت های درمانی موجب شد تا اواخر دهه 1960 و اوایل دهه 1970 درمان بستری به معالجه سرپایی مبدل گردید که به علت همزمان کاهش قابل ملاحظه موارد بیماری سل در جوامع مختلف عمدتا در کشورهای پیشرفته منجر به عدم مراقبت و پیشگیری جدی در درمان گردید. عاقبت این امر سبب افزایش تعداد موارد شکست درمان، عود پس از درمان و بروز مقاومت دارویی گشت در اغلب این کشورها شیوع موارد مقاوم در طی سه دهه اخیر از 2% به بالاتر از 9% رسیده است این وضعیت متاسفانه در کشورهای در حال رشد بسیار تاسف آور تر است
از طرفی مصرف نادرست یا نامنظم داروها یا قطع بی مورد آنها باعث می شود برخی باسیل های مولد سل بدون خدشه ،تکثیر یافته و ایجاد فرم های جدید مقاوم به دارو کند و نیز بیماران مبتلا به اشکال شدید سل قطع غیر ضروری داروها خود عامل تهدید کننده حیات محسوب می شود.
[1] International Union Against Tuberculosis and Lung Disease
[2] Directly Observed Treatment Short Course
[3] Directly Observed Treatment Short-course Strategy