مقدمه
آزمايشهاي تست حساسيت ميكروبي ميتواند براي پيداكردن داروي موثر، اپيدميولوژي و پيش بيني نتيجه بعد از درمان بيماري مورد استفاده قرار گيرد.
در اين مطالعه ما روي روشهاي آزمايشگاهي آنتي ميكروبي در آزمايشگاه براي بررسي كشف و استخراج خاصيت ضد ميكروبي داروها بر روي عوامل بيماري زا ميپردازيم.پس از انقالب در دوران طاليي، تقريبا تمام گروههاي آنتي بيوتيكهاي مهم )تتراسايكلين ها، سفالوسپورين ها، آمينوگليكوزيدها و ماكروليدها( كشف شده بودند و از مشكالت اصلي شيمي درماني در دهه 1960كم شده بود، اما در حال حاضر اين تركيبات به دليل افزايش مقاومت ميكروبي به شدت در خطر از دست دادن اثرات ضد ميكروبي خود ميباشند و با توجه به وقوع شكست درماني در رابطه با مقاوم شدن باكتريها به چند دارو به يك نگراني جهاني براي بهداشت عمومي تبديل شده است به همين دليل، كشف آنتي بيوتيكهاي جديد هدف اختصاصي بسيار مهم است. محصولات طبيعي هنوز هم يكي از منابع اصلي مولكولهاي دارويي جديد امروز ميباشند كه از باكتريهاي پروكاريوت، ميكروارگانيسمهاي يوكاريوت، گياهان و موجودات زنده مختلف و حيوانات مشتق شده اند. محصولات ميكروبي و گياهي بخش عمدهاي از مواد ضد ميكروبي كه تا به حال كشف شده اند را به خود اختصاص داده اند.
گياهان و ديگر منابع طبيعي ميتوانند طيف وسيعي از تركيبات پيچيده و ساختار متنوع را فراهم كنند. به تازگي، بسياري از محققان در اين تحقيقات برروي گياهان و عصارههاي ضد ميكروبي، روغنها و اسانس ها، مواد متابوليتي ثانويه و مولكولهاي جديد مصنوعي به عنوان عوامل ضد ميكروبي بالقوه متمركز شده اند. اين يك واقعيت است كه خاصيت ضد ميكروبي عصاره هاي استخراج شده از گياهان بسيار عالي است اما اين قسمت از دادههاي اوليه بايد مورد اعتماد بوده و به محققان اجازه مقايسه نتايج را بدهند و بايستي محققان از تحقيق روي خاصيت ضد ميكروبي اينها فقط به عنوان يك مطالعه فتوشيميايي اجتناب نمايند. انواع روشهاي آزمايشگاهي ميتواند براي ارزيابي و يا غربالگري فعاليت ضد ميكروبي در شرايط Invitro روي عصاره يا يك تركيب خالص مورد استفاده قرار گيرد.
معروف ترين و اساسي ترين روشها انتشار ديسك، محيط مايع و رقيق كردن در محيط آگار هستند. روشهاي ديگر اختصاصي براي آزمايشهاي ضدقارچ، استفاده از تكنيك مواد غذايي سمي ميباشد. براي مطالعه تاثير ضد ميكروبي با توجه به جذابيتهاي جديد خواص محصولات ضد ميكروبي جديد مانند مبارزه با باكتريهاي مقاوم به چند دارو، بسيار مهم است كه به منظور گسترش يك درك بهتر از روشهاي فعلي موجود براي غربالگري و يا كميت اثر ضد ميكروبي عصاره يا يك تركيب خالص براي آن برنامه هاي كاربردي در سلامت انسان، كشاورزي و محيط زيست داشته باشيم
روشهاي انتشار
روش انتشار ديسك در آگار (diffusion-disk Agar)
اين روش در سال 1940 گسترش يافت و يك روش معمول مورد استفاده در بسياري از آزمايشگاههاي ميكروبشناسي باليني براي تست حساسيت ميكروبي ميباشد. امروزه، بسياري از استانداردهاي پذيرفته شده و تاييد شده توسط موسسه استاندارد باليني و CLSI براي باكتريها و مخمرهاي مورد بررسي منتشر شده است. با وجود اين كه همه باكتريهاي مشكل پسند را نميتوان به طور دقيق با اين روش آزمايش كرد، استاندارد سازي اين گونه باكتريها مثل استرپتوكوك، هموفيلوس آنفلوآنزا، هموفيلوس پاراآنفلوآنزا، نايسريا گونوره و نايسريا مننژيتيديس با استفاده از محيطهاي كشت مخصوص، شرايط مختلف انكوباسيون و معيارهاي تفسيري براي ناحيه هاي مهار رشد انجام شده است. در روش انتشار ديسك در آگار، پليت آگار با مقدار استانداردي از ميكروارگانيسم مورد آزمايش تلقيح ميشود سپس، ديسكهاي كاغذ فيلتر (حدود 6 ميلي متر در قطر) حاوي تركيب تست در غلظت مورد نظر بر روي سطح آگار قرار داده ميشود. پتري ديش تحت شرايط مناسب انكوبه ميشود.

معمولا عامل ضد ميكروبي در آگار پخش شده و مانع جوانه زني و رشد ميكروارگانيسم مورد آزمايش شده و پس از آن قطر ناحيه مهاركننده رشد اندازه گيري ميشوند. (شكل1 ) آنتي بيوگرام بر اساس نتايج كيفي باكتريها را به گروه حساس، نيمه حساس و يا مقاوم طبقه بندي ميكند. بنابراين، اين روش به عنوان يك ابزار پايه اي براي تعيين نوع فنوتيپ مقاومت در بين باكتريهاي آزمايش شده ميباشد و نتايج آن نيز ميتواند به پزشكان در انتخاب درمان تجربي اوليه مناسب و نوع آنتي بيوتيك استفاده شده براي هر بيمار در شرايط خاص كمك نمايد. با اين حال، از آنجا كه مهار رشد باكتري به معني مرگ باكتري نيست لذا اين روش نميتواند تاثيرات) bactericidal كشتن باكتري( و bacteriostatic(متوقف كننده رشد باكتري) يك دارو را از هم تشخيص دهد
، روش ديسك ديفيوژن مزاياي بسياري نسبت به روشهاي ديگر دارد: سادگي، كم هزينه بودن، توانايي تست تعداد زيادي از ميكروارگانيسمها و عوامل ضد ميكروبي و سهولت براي تفسير نتايج. عالوه بر اين، چندين مطالعه رضايت باالي بيماراني كه داراي عفونت باكتريايي بوده اند و از درمان ضدباكتريايي خود از روشهاي بر پايه آنتي بيوگرام براي تشخيص و درمان استفاده كرده اند را نشان ميدهد(۱)
روش MIC و MBC
Minimum Inhibitory Concenteration به كمترين مقدار از آنتي بيوتيك اتلاق مي شود كه مي تواند به طور قابل توجهي رشد يك ارگانيسم را پس از گذشت يك دوره انكوباسيون مشخص (16 تا 20 ساعت بسته به گونه باكتري ) مهار نمايد
Minimum Bacteriocidal Concenteration به كمترين غلظت از آنتي بيوتيك اطلاق ميشود كه مي تواند پس از گذشت 24 ساعت جمعيت باكتريايي را به ميزان۹ /99 ٪كاهش دهد به عبارت ديگر ، جمعيت اوليه را هزار بار كاهش دهد .
در عمل ، تجويز يك آنتي بيوتيك هيچگاه به طور كامل موجب نابودي جمعيت باكتري ها نمي شود ، بلكه صرفا يا رشد باكتري متوقف مي شود (خاصيت متوقف كنندگي رشد ) ويا تعداد آنها به حداقل كاهش مي يابد (تاثير باكتري كشي ) .در نهايت همواره اين دستگاه ايمني است كه نابود سازي جمعيت باكتري ها را بر عهده دارد
MIC 50 : حداقل غلظت آنتي بيوتيكي كه ميتواند 50% از تمآمي سويه هاي باكتريايي تحت آزمايش را مهار نمايد .
MIC 90 : حداقل غلظت آنتي بيوتيك كه ميتواند 90% از تمامي سويه هاي باكتريايي تحت آزمايش را مهار نمايد .
MIC 50 ,MIC 90 را به منظور مقايسه حساسيت يك ميكرو ارگانيسم با ديگري و همچنين ارزيابي همان ميكروارگانيسم در این روش ما دارای ۱۰ عدد لوله آزمایش میباشیم که در هر لوله ۵۰۰ میکرو لیتر محیط کشت TSB که قبلاً اتوکلاو شدهاست قرار دارد. در ابتدا برای رقت سازی در مقدار ۵۰۰ میکرو لیتر از عصاره متانولی یا اتانولی را به لوله شماره یک اضافه میکنیم؛ و لوله شماره یک را به وسیله شیکر کاملاً مخلوط میکنیم و بعد از لوله شماره یک ۵۰۰ میلی لیتر محلول (عصاره +TSB را برداشته و به لوله شماره دو اضافه میکنیم و به همین ترتیب تا لوله شماره هفت پیش میرویم که در نهایت بعد از شیکر کردن لوله شماره هفت ۵۰۰ میلی لیتر از محلول را دور میریزیم.
حالا ۱۰۰ میکرو لیتر از سوسپانسیون باکتری که برابر با نیم مک فارلند تهیه کردیم به همه هفت لوله اضافه میکنیم. حالا لوله شماره هشت که حاوی محیط عصاره + TSB (یعنی بدون باکتری) است. لوله شماره نه محیط TSB+ باکتری بدون عصاره که برای تعیین کدورت رشد باکتری به عنوان شاهد رشد استفاده میکنیم. لوله شماره ده که محیط TSB است به عنوان شاهد کدورت نداشتن محیط است (یعنی باکتری اگر رشد نکند باید به شکل این لوله شفاف باشد). برای این آزمایش غلظتهایی از ۵۰۰، ۲۵۰، ۱۲۵٬۶۲/۵، ۳۱/۲۵، ۱۵/۶۲، ۷/۸۱ را استفاده کردیم. نتیجه MIC بر اساس کدورت محیط کشت که نشان دهنده رشد باکتری است بررسی میگردد (۱)
بعد از اینکه MIC را تعیین کردیم از لولهها بر روی محیط کشت مولر هیلتون آگار استریل شود، به وسیله سوآپ کشت میدهیم که این پلیتها به مدت 16 تا18 ساعت در انکوباتور 35 درجه سانتی گراد قرار میدهیم و رشد باکتری نشان دهنده MBC میباشد.(۲)
روش انتشار روي سطح آگار نميتواند روش مناسبي براي تعيين حداقل غلظت ممانعت كنندگي MIC باشد و در آن تعيين مقدار غلظت ماده ضد ميكروبي منتشره در محيط آگار امري غير ممكن ميباشد. يك MIC تقريبا ميتواند براي برخي از ميكروارگانيسمها و آنتي بيوتيك با مقايسه محدوده عدم رشد الگوريتمهاي ذخيره شده را محاسبه نمايد. اين روش تركيبي از روش اصلي رقيق سازي و روش تغليظ به منظور تعيين اندازه MIC بوده كه با ايجاد يك غلظت گرادياني از عامل ضد ميكروبي آزمايش شده در محيط آگار همراه ميباشد.
Etest يك فرم تجاري از اين روش است. در اين روش، يك نوار آغشته با غلظت گرادياني افزايشي با عامل ضد ميكروبي از يك انتها به قسمت ديگر بر روي سطح آگاري پخش ميشود كه قبال با ميكروارگانيسم مورد آزمايش مورد تلقيح قرار گرفته است. اين روش براي تعيينMIC آنتي بيوتيك ها، ضد قارچها و ميكروبهاي ضد قارچ استفاده ميشود. ارزشMIC در تعيين قسمتهاي قطع شده نوارها و محدودههاي مهار رشد ميباشد. بنابراين، اين روش را به طور معمول بر اساس درخواست پزشكان معالج به كار ميبرند، با اين حال، هزينه هر نوار test-E ،2 تا 3 دالر است.
بنابراين، اين روش در صورت آزمايش با داروهاي متعدد هزينه زيادي در بر خواهد داشت. مطالعات قبلي همبستگي خوبي بين مقاديرMIC تعيين شده توسط test-E و روشهاي dilution broth يا dilution agar نشان ميدهد. اين تكنيك همچنين ميتواند رابطه ضد ميكروبي بين دو دارو را هم بررسي نمايد. به منظور بررسي اثر تركيبي از دو آنتي بيوتيك ها، نوار test-E ،ابتدا با يك آنتي بيوتيك انجام ميشود و سپس بر روي يك محيط كه قبال با ميكروارگانيسم تلقيح شده است قرار داده ميشود. بعد از يك ساعت، نوار برداشته شده و با يك آنتي بيوتيك ديگر آغشته شده جايگزين ميگردد. همچنين براي همان هدف، نوار test-E را ميتوان در محيط كشت آگار در يك حالت به صورت متقابل و با يك زاويه 90 درجه در محل مقابل بينMIC و ميكروارگانيسم مورد آزمايش قرار داد. پس از انكوباسيون، شاخص كسري غلظت مهاري )FICI )را ميتوان با استفاده از فرمول زير محاسبه نمود: هم افزايي آن با FICI كمتر يا مساوي 5/0 و آنتاگونيستي آن با FICI بيشتر از 4 تعيين ميگردد. FICI بين 5/0 و يك به عنوان آزمايش داراي تفسير افزايشي و بين 1 تا 4 بدون تفسير گزارش ميشود.
روشهاي رقيق سازي اين روشها يكي از مناسب ترين روشها براي تعيين ارزش MIC هستند چرا كه توانايي تعيين غلظت عامل ضد ميكروبي آزمايش شده در آگار )رقت در آگار( يا در محيط مغذي )رقت باال يا رقت پايين( را دارند. در هر دو صورت محيط مغذي يا روش رقت در آگار به لحاظ كمي اندازه گيري فعاليت ضد ميكروبي در شرايط in vitro براي باكتريها و قارچها مورد استفاده قرار ميگيرد. ارزش ثبت شدهMIC به عنوان كم ترين غلظت از عامل ضدميكروبي مورد سنجش قرار گرفته است كه مهار رشد قابل توجهي از ميكروارگانيسم آزمايش شده را نشان ميدهد و معموال بر اساس ميلي گرم در ميلي ليتر يا ميلي گرم بر ليتر بيان شده است. بسياري از دستورالعملهاي تاييد شده براي ميزان رقت تست حساسيت ميكروبي از باكتريهاي اسيد فاست و غير اسيد فاست و مخمر و قارچهاي رشتهاي وجود دارد. مهم ترين استانداردهاي شناخته شده توسط CLSI و كميته اروپايي ضد ميكروبي آزمايش تعيين حساسيت EUCAST ارائه شده است. به عنوان توصيه، اين دستورالعمل يك روش يكسان براي اين تست است كه به صورت عملي براي انجام كار در اكثر آزمايشگاه ميكروب شناسي باليني فراهم مينمايد. توسعه اين چنين روشهاي استاندارد ارتباطات باليني با اين تستها را تضمين نميكند. با اين وجود اين روشها اجازه ميدهند كه يك ارزشيابي در يك رويكرد استاندارد به منظور ارزيابي ارتباط باليني نتايج انجام گيرد.
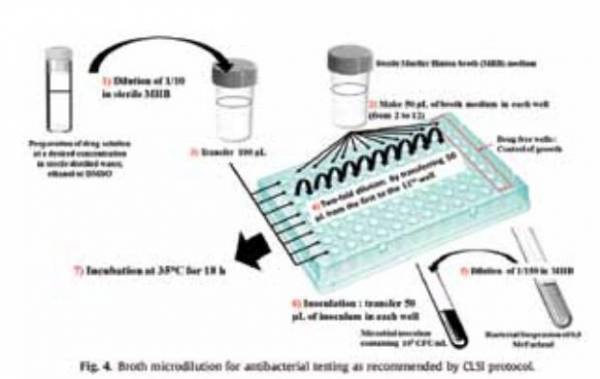
روش رقيق كردن در محيط مايع Broth dilution
رقت به صورت Micro يا Macro در محيط مايع يكي از اساسي ترين روشهاي آزمايش حساسيت مواد ضد ميكروبي است. اين پروژه مستلزم آماده كردن 2 تارقت از يك ماده ضدميكروبي )به عنوان مثال 1،2،4،8،16و32 ميكروگرم بر ميلي ليتر( در يك محيط كشت مايع است كه به لوله هاي حاوي حداقل حجم 2 ميلي ليتر توزيع ميشود كه اين روش Macrodilution ناميده ميشود و در Microdilution از لوله هاي با حجم كمتر مانند پليت ميكروتيتراسيون داراي 96 خانهاي استفاده ميشود. سپس هر لوله را با حجم مناسبي از تلقيح ميكروبي آماده شده در همان محيط بعد از رقيق كردن سوسپانسيون ميكروبي استاندارد شده تلقيح ميكنند تا كدورت معادل 5.0 در مقياس مك فارلند به دست آيد. پس از اين كه به خوبي مخلوط شدند لوله هاي تلقيح شده يا پليت 96 خانهاي را انكوبه كرده )اغلب بدون تكان دادن( و تحت شرايط مناسب بسته به ميكروارگانيسم مورد آزمايش كه انكوبه شده است قرار ميدهند. روش تجربي با انجام دقيق Microdilution در شكل نشان داده شده است.
برخلاف روش Microdilution ،از معايب اصلي روش Macrodilution خسته كننده بودن، نداشتن كتابچه راهنماي كاربر، خطر به وجود آمدن خطا در آماده سازي روشهاي ضد ميكروبي براي هر آزمايش و مقدار نسبتا زيادي از معرف و فضاي مورد نياز ميباشد. بنابراين تكرار پذيري و مقرون به صرفه بودن و فضايي كه با توجه به كوچك سازي آزمون رخ ميدهد مزيتهاي عمدهاي از روش Microdilution به شمار ميروند با اين وجود، اگر نتايج تكرار پذير (داخل آزمايشگاهي و بين آزمايشگاهي) به دست آمده تحت تاثير قرار ميگيرد نتيجه نهايي با استفاده از اين روش، بايد به طور قابل توجهي به دقت كنترل گردد. براي تعيين نقطه پاياني MIC ،با مشاهده دستگاه ميتوانيد با خواندن آزمايش Microdilution و نوشتن نتايج با توانايي باال تشخيص رشد در چاهك را آسان نماييم. عالوه بر اين، چندين روش بر اساس استفاده از معرف رنگ توسعه يافتهاند. نمك تترازوليوم 3(-5،4 -ديمتيل تيازول-2-YL-)2،5 –ديفنيل تترازوليوم برومايد )MTT )و 2،3 – bis( 2 -متوكسي 4 نيترو5 سولفونيل آمينوكربونيل 2H – تترازوليوخ هيدرواكسايد (XTT )كه اغلب در تعيين MIC نقطه پاياني براي هر دو روش ميكرودايلوشن ضد قارچ و ضد باكتري استفاده ميشوند. رنگ االمار آبي )رزازورين( به عنوان يك شاخص موثر رشد همچنين ميتواند براي اين منظور استفاده گردد. اندازه تلقيح، نوع محيط رشد، گذشت زمان و روش آماده سازي تلقيح ميتواند مقاديرMIC را تحت تاثير قرار بدهد.
منابع
- مروری بر روش های ارزیابی فعاليت های ضد میکربی در آزمایشگاه(فصلنامه آزمایشگاه و تشخیص بهار ۱۳۹۶ – شماره ۳۵)
- مجله میکرب شناسی پزشکی ایران سال۷ شماره ۳ پاییز ۱۳۹۲